研究内容
研究分野: 医用材料と医療機器・DDS・再生医療
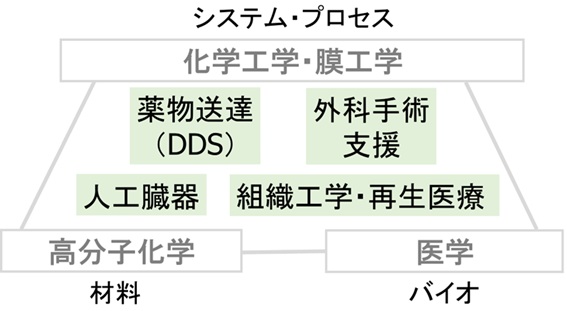
医療の臨床現場においては様々な医用材料が用いられています。その応用範囲は様々な治療・診断・予防を支える裾野の広い学問分野となり、発展しています。また、医用材料は工学・医学・薬学とオーバーラップする学際的な分野であり、化学に加えて、物理学・生物学からも、多面的に現象を捉える必要があります。臨床のニーズに基づいて、分子レベルでの高分子医用材料の設計・開発から、細胞・個体レベルでの医療機器・DDS・再生医療/組織工学への応用研究まで取り組んでいます。学術的方法論として以下の3分野を大事にしております。
基盤学問分野: 化学工学・基礎医学・高分子化学
化学工学
本研究室では、化学工学と膜工学を中心に据え、基礎医学と高分子化学を両輪にしています。様々な治療機器において、化学工学における物質・熱・運動量の移動や化学反応を包含する化学システムとして捉えて、設計・最適化する手法が極めて重要です。加えて、人工材料と生体材料を一体のシステムとして統合化する視点も重要です。多くの現象は人工物と生体の界面で起こります。界面での物質移動や反応などを扱うことができる膜工学を大事な学問的基盤としています。
基礎医学
優れた医用材料の開発と応用には、基礎医学や生物学の視点が必要不可欠です。疾患治療のために、医用材料や薬物・細胞を担持した医用材料を体内に投与すると、細胞レベル・個体レベルでの様々な応答が起こります。医用材料を投与した際の、炎症、凝固・線溶、線維化などの生体の応答を、生命科学的に研究することが必要不可欠です。また医用材料は薬物や細胞のキャリアや足場材料として用いられます。細胞が材料の内部や表面とどのように相互作用するか、より深く探究する必要があります。そして最終的に、治療効果は医学に基づいて定量的に議論されます。
高分子化学
生体内においては、高度に構造や機能が制御された生体分子である、多糖類・タンパク質・核酸・脂質などが、協調して生命現象を司っていますが、この中で多糖類・タンパク質・核酸は高分子です。本研究室では、高分子合成化学と高分子物性の両面から、主に生体分子を材料として新しい医用材料を研究、開発しています。また分子や材料を設計するにあたって、Biomimetic Chemistry, Bio-inspired Chemistryとも呼ばれる、生体の持つ様々な階層での精緻な構造・機能・合理性に基づいた着想を大事にしています。
応用研究分野: 医療機器・DDS・再生医療
主に東京大学医学部附属病院や学外医療機関との共同研究にて、疾患治療への応用研究を積極的に進めています。
ドラッグデリバリーシステム (DDS)
DDSとは“必要最小限の薬物を、必要な場所に、必要なタイミングで供給する”技術です。DDSの中の基本的な概念の一つは薬物徐放です。薬理効果を示す濃度以上になると副作用が大きくなり、それよりも低くなると薬剤は効果を示しません。なるべく薬理効果領域で長い時間薬剤濃度が維持されると、薬理効果の向上、副作用の低減、投与回数の低減、QOLの向上が期待されます。局所投与を中心に、胃がんや卵巣がんの腹膜播種、胆道がん、膵がん、中皮腫、強皮症、ケロイドのDDSに取り組んでいます。また近年のバイオセンサー、無線給電、デジタルヘルス技術などの進歩に伴い、磁場や超音波などの外部からの刺激に応じて薬物を放出するOn-demand DDSの実現が期待されており、この分野の研究にも積極的に取り組んでいます。

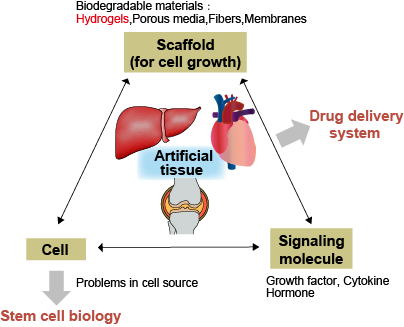
再生医療・組織工学
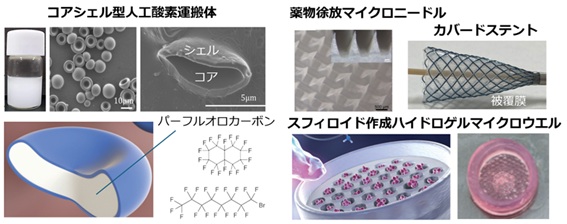
組織工学(Tissue Engineering)は、細胞・足場材料(スキャフォールド)・液性因子の3種類を組み合わせ、プロセス制御を行い、組織を再生する試みです。injectableハイドロゲル、マイクロカプセル、ゲルマイクロウエルなどは、移植容易な足場材料として用いることが可能です。本研究室では、膵島再生や骨再生を対象に、ハイドロゲルを利用した、細胞の分化、移植による機能発現、血管新生に関する研究を行っています。また、再生医療の3次元組織構築においては、酸素供給がボトルネックとなっています。本研究室では、エラストマーのシェルとコアに酸素溶解性が高いフッ素材料であるパーフルオロカーボンを用い、ヒト赤血球のような形状と柔軟性を持った新しいコアシェル型人工酸素運搬体を用いて、3次元組織再生プロセスや組織・臓器保存の研究に取り組んでいます。
医療機器 (癒着防止材・狭窄防止材・組織接着材・創傷被覆材)
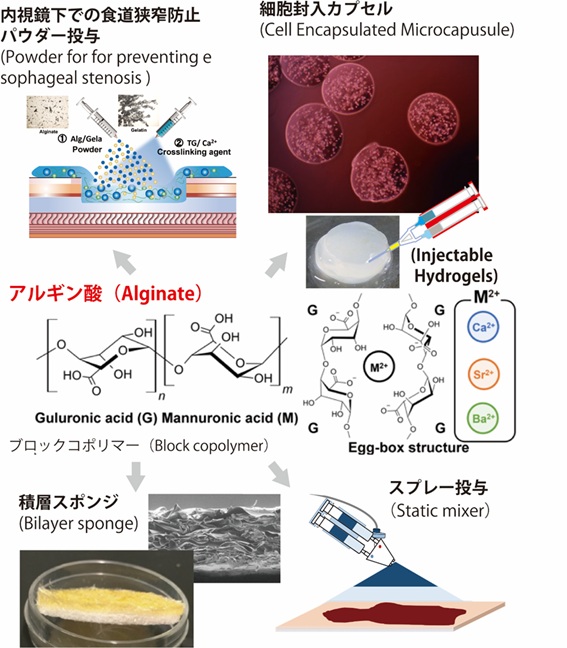
開腹手術や腹腔鏡手術後に、臓器同士、あるいは腹腔を包む腹膜と臓器がしばしば癒着し剥れなくなります。これを腹膜癒着といいます。肝臓がんの切除でも、高頻度で癒着が起こり、手術の安全性低下や手術の長時間化などの原因になっており、新たな癒着防止材料の開発に取り組んでいます。またすい臓がんの手術では、離断面からの膵液の漏れによる起こる膵液瘻と呼ばれる合併症が問題となっており、膵液瘻防止材料が期待されています。また消化管内視鏡でESD(内視鏡的粘膜下層はく離術)などの処置をした後に起こる消化管狭窄が問題になっており、狭窄防止材料の開発も必要不可欠です。外科手術全般において、止血や組織修復は重要であり、効果的な止血材の開発も行っています。これらの医療機器は、医師が治療を安全に行うために臨床において必要不可欠な医療機器です。またDDS技術と組みわせたコンビネイションプロダクトとしての研究も必要です。細胞シートなどの再生医療技術と組み合わせた新しいアプローチも試みています。臨床のニーズに応えられるように、鋭意研究に取り組んでいます。
研究内容1: 医用ハイドロゲルの開発
注射器やカテーテルで注入可能なハイドロゲル(injectable hydrogel)は、低侵襲治療への応用が期待されています。生体由来の様々な多糖類やたんぱく質を骨格高分子とし、生体内で安全な化学反応を用いて、多種多様なハイドロゲルを創製することが可能です。腹腔鏡や軟性内視鏡、手術ロボットなどで投与が容易な点から、再生医療・薬物徐放担体・腹膜癒着防止材・狭窄防止材・止血剤・組織接着剤など、幅広い応用が期待されています。
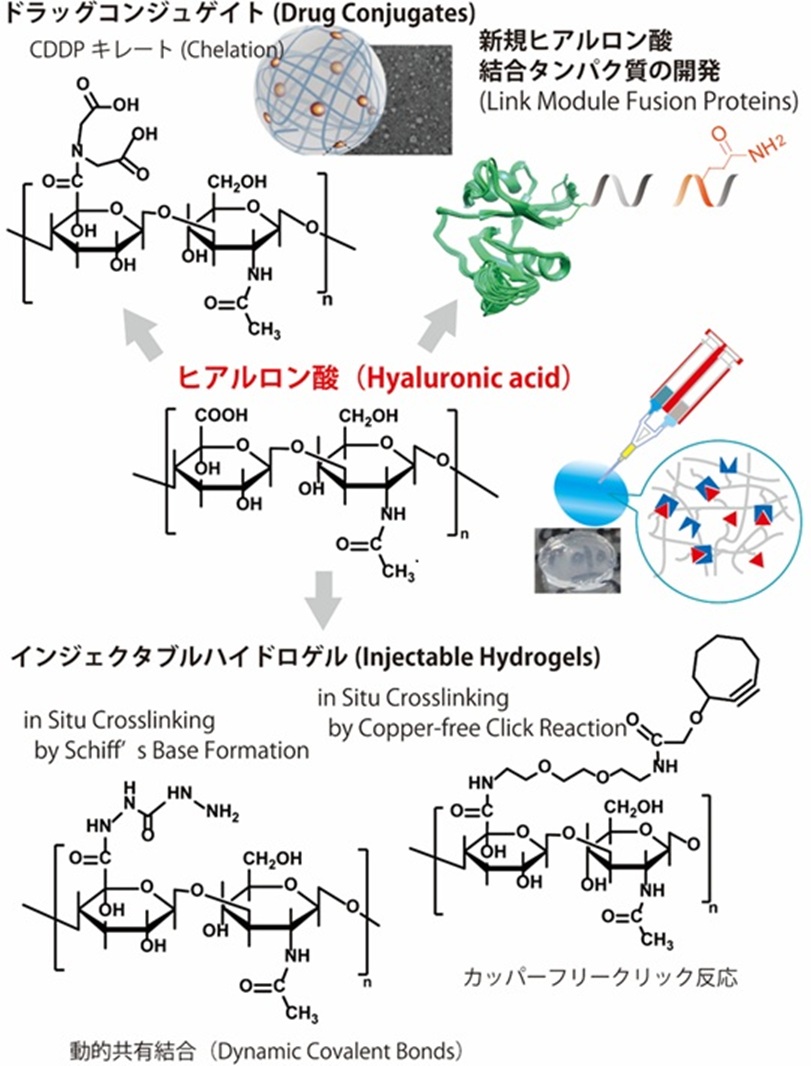
天然多糖類である、ヒアルロン酸は細胞外マトリックス(ECM)の構成成分であり、独特の粘弾性挙動と、高い保水性を持ち、かつ生体内での生体適合性に非常に優れています。クリックケミストリーや動的共有結合に着目し、特にシアシニング性や自己修復性を持ったハイドロゲルの研究に積極的に取り組んでいます。
ハイドロゲルや多糖類はDDS(Drug delivery system)への応用も期待されています。近年、抗体と薬物をLinkerにより結合したADC(Antibody-drug conjugate)の臨床応用が進んでおり、この分野の研究はますます活発です。我々は多糖類のDrug Conjugateの研究に取り組んでいます。またコンジュゲイト体は自発的に物理架橋が進み、ナノサイズのゲルとして設計することもできます。
さらにヒアルロン酸はヒアルロン酸に特異的に結合するCD44、TSG-6、Aggrecanといった多様なヒアルロン酸結合タンパク質と協調して機能を発現しています。これらのタンパク質はリンクモジュールと呼ばれる共通の構造を持っています。タンパク質工学を融合し、ヒアルロン酸結合性タンパク質の研究を行っています。
アルギン酸は、二価イオンであるCa2+イオンでエッグボックス構造と呼ばれるユニークなキレート構造を取って迅速にゲル化する性質を持っており造形性に優れています。昆布などから抽出され、生体適合性や安全性も高く、細胞封入材料としても有用です。
またデバイスの構造や機能は、投与プロセスに大きく依存します。ハイドロゲルをスプレーやパウダーとして投与することで、治療性能や操作性を大きく進歩させることができます。このため素材開発に加えて、化学工学が重要です。スタティックミキサーやエレクトロスプレー、アトマイザーなどを用いたプロセスの研究を行っており、トーラス状ゲル粒子の研究も行っています。3Dプリンターに代表されるAM(Additive manufacturing)技術が急速に進歩しており、ハイドロゲルをベースとしたバイオインクの開発に取り組んでいます。
その他にも、キトサン、デキストラン、カルボキシメチルセルロース、キサンタンガム、グアーガム、ヘパリンなど多種多様な天然多糖類や、タンパク質であるコラーゲンやゼラチン、アルブミンなどを用いています。
研究内容2: 医用膜と医用微粒子の開発
DDSにおける薬物徐放は材料中の物質移動プロセス制御であり、テープや湿布などの製剤設計は膜工学を基盤にしています。人工肺、人工腎臓などの人工臓器は中空糸膜をモジュール化したもので、膜工学を基盤にしています。またバイオ医薬品の製造プロセスにおいても、純水製造のために逆浸透膜、精製のための限外ろ過膜や精密ろ過膜などの分離膜が数多く使用されています。
乾燥は分離工学の単位操作の一つに位置付けられます。本研究室では、凍結乾燥プロセスを用いた体内溶解型の多孔スポンジや、共同研究にてマイクロニードルの研究を行っています。また血管や消化管治療に用いられるカバードステントのステント被覆膜の研究にも取り組んでいます。被覆膜は伸縮性が高いエラストマー材料を用いるのが一般的です。
マイクロ粒子は様々な作製法がありますが、本研究室ではSPG膜乳化法を中心に用いています。SPG膜は0.5~30µmの範囲内でチューニングされた均一細孔を有するガラス多孔膜です。膜乳化法は、膜細孔を通して連続相中に分散相を押し出すことによって、非常に均一なエマルションを作る技術です。本研究室では、ポリ乳酸グリコール酸(PLGA)を用いた酵素や抗がん剤を徐放する薬物徐放微粒子や、ヒト赤血球のサイズが8µm程度であることに着目したコアシェル型やハイドロゲル型の人工酸素運搬体(人工赤血球)を行っています。
リポソームは、両親媒性を持つリン脂質が細胞膜のように二分子膜を構成したカプセルです。DDS担体として長年にわたって研究が続けられています。本研究室では、リポソームの研究も行っております。
膜工学の医療における深化と拡大を追究し、臨床に価値ある技術の開発を目指しています。